coronavirus
Autorizaron la aplicación de la vacuna monodosis Sputnik Light
Anmat aprobó «con carácter de emergencia» el uso de la vacuna Sputnik Light, que es la versión monodosis de la vacuna rusa.
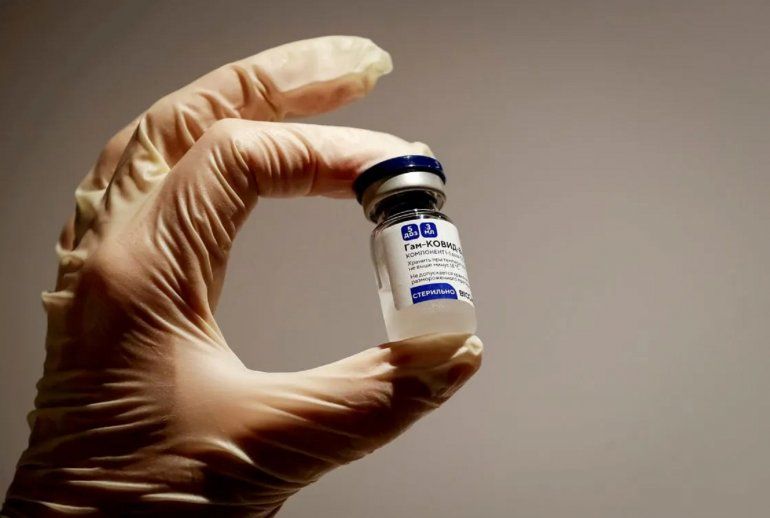
El Gobierno autorizó este lunes "con carácter de emergencia" la vacuna Sputnik Light contra el coronavirus, del Centro Nacional de Investigaciones Gamaleyade Epidemiología y Microbiología, y el Ministerio de Salud de la Federación de Rusia,que es la versión monodosis de la conocida Sputnik V.
La medida fue publicada en el Boletín Oficial, y se conoce en medio de la preocupación mundial que despierta la expansión de la variante ómicron y la detección del primer caso de un paciente con esa cepa en el país. A través de la resolución 3451, la ministra de Salud, Carla Vizzotti decidió avalar el inmunizante, luego de la recomendación realizada por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT).
Según el marco normativo, la autorización de uso de emergencia dada por el Ministerio de Salud ocurre luego de la intervención de distintos organismos, entre ellos la ANMAT que revisa la evidencia científica y sugiere la aprobación.
Asimismo, en el caso de las compañías farmacéuticas públicas o privadas con representación en el país, que son titulares regulados por la ANMAT, el procedimiento a seguir es el registro de una vacuna, ya sea de emergencia o en forma definitiva.Esto fue lo que ocurrió con las vacunas Pfizer o AstraZeneca.
En este caso, la cartera de Salud tuvo en cuenta que la ANMAT ha recibido "de manera secuencial" la información correspondiente, según parámetros requeridos sobre "las plantas elaboradoras, el desarrollo y la elaboración de los productos, su certificación en el país de origen y el cumplimiento de los estándares de calidad".
Se consignó además que se accedió "a información sobre su seguridad y eficacia, así como a la que indica que no se han presentado eventos adversos graves, ni se han identificado diferencias significativas en la eficacia observada en los diferentes grupos etarios que participaron de los ensayos clínicos".
En su informe al Ministerio de Salud, el organismo regulatorio indicó sobre esta vacuna: "Se presenta como una herramienta terapéutica segura y eficaz de acceso para que nuestro país baje la mortalidad, reduzca la morbilidad y disminuya la transmisibilidad de la enfermedad COVID-19 producida por el virus SARS-Cov-2.".
En una reciente entrevista concedida a LA NACION, el director ejecutivo del Fondo Ruso de Inversión Directa (RDIF), Kirill Dmitriev,señaló que Sputnik Light ha demostrado "una eficacia superior a algunas vacunas de dos dosis" contra la variante delta. "Administrada sola, la Sputnik Light ha demostrado un 70% de eficaciacontra la infección por variante delta durante los tres primeros meses posteriores a la vacunación. La vacuna tiene una efectividad del 75% en personas menores de 60 años", afirmó Dmitriev.
El director ejecutivo del RDIF profundizó: "Todo eso la convierte en un verdadero refuerzo universal de todas las otras vacunas, contribuyendo a lograr una inmunidad fuerte y prolongada, incluso contra nuevas mutaciones, como la ómicron".
La vacuna
La Sputnik Light es el primer componente —adenovirus recombinante humano del serotipo 26 (Ad26)— de la vacuna Sputnik V, que fue la primera vacuna registrada en el mundo contra el coronavirus y se utiliza en más de 15 países, y se encuentra en proceso de autorización en otros 30.
Según el Centro Gamaleya, Sputnik Light es una vacuna muy eficaz cuando se usa tanto de forma independiente como aplicada como refuerzo. Además de los rusos, otros socios internacionales del país que conduce Vladimir Putin empezarán a producir la vacuna, como es el caso de India, China, Corea del Sur, Vietnam, México, Argentina, Serbia y Turquía, entre otros.
De acuerdo a un reciente artículo publicado en la revista británica The Lancet, el estudio de fase 1/2 sobre seguridad, tolerabilidad e inmunogenicidad, llevado adelante en 110 voluntarios con buena salud de entre 18 y 59 años, mostró que Sputnik Light induce una fuerte respuesta inmunitaria humoral y celular tanto en los grupos seronegativos como seropositivos.
Según los autores de ese trabajo, la mayoría de las reacciones adversas observadas durante el estudio fueron leves o moderadas. Y remarcaron que no se detectaron eventos adversos graves.

coronavirus
Argentinos y residentes vacunados no deberán presentar PCR para ingresar al país
No se exigirá la prueba PCR a aquellos argentinos y residentes con el esquema completo de vacunación que deseen ingresar al país.

El Gobierno nacional oficializó este miércoles la decisión de eximir de la presentación de un PCR para ingresar al país a los argentinos y residentes que cuenten con el esquema completo de vacunación contra el Covid.
La medida, adelantada la noche del jueves, fue publicada en el Boletín Oficial a través de la decisión administrativa 63, y entrará en vigencia a partir del próximo sábado.
Desde ese día, como condición para no tener que hacerse el PCR para ingresar al país, los argentinos y residentes deberán haber completado el esquema de vacunación por lo menos 14 días antes de su ingreso al país.
Para el caso de los argentinos o las argentinas que hubieran residido en el exterior durante al menos el último año, se entenderá por esquema de vacunación contra el covid completo al definido por las autoridades sanitarias del país de residencia.
Además, las personas vacunadas con esquema completo estarán eximidas de realizar la cuarentena.
Quienes tengan esquema de vacunación incompleto o no estén vacunados deberán contar con una prueba de PCR negativa realizada en el país de origen dentro de las 72 horas previas al inicio del viaje o una prueba de antígeno realizado en el país de origen dentro de las 48 horas previas al inicio del viaje.
El costo de las pruebas quedará a cargo de la persona que ingrese al país.
La decisión administrativa lleva la firma del jefe de Gabinete, Juan Manzur, y los ministros de Interior, Eduardo De Pedro, y de Desarrollo Social, Juan Zabaleta, según publicó Télam.
-

 Tragedia12 horas ago
Tragedia12 horas agoHallaron sin vida al chofer que auxilió a las hermanitas desaparecidas en Bahía Blanca
-

 Victoria2 días ago
Victoria2 días agoVictoria: 8 personas resultaron heridas en el choque frontal en Ruta 11
-

 Seguridad vial2 días ago
Seguridad vial2 días agoEn plena tormenta, volcó un camión en Ruta 12
-
 Clima2 días ago
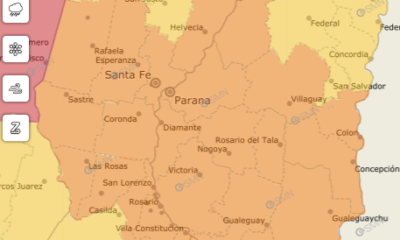
Clima2 días agoAtención: Alerta naranja para este sábado en Entre Ríos
-

 Mascotas12 horas ago
Mascotas12 horas agoRevelan el destino del perro que atacó a una niña de 3 años en Entre Ríos
-

 Policiales23 horas ago
Policiales23 horas agoApuñalaron a dos jóvenes en un boliche de Paraná: hay dos detenidos
-

 Defensa civil2 días ago
Defensa civil2 días agoBahía Blanca: diez muertos, operativos de rescate en una situación desesperante
-

 Clima23 horas ago
Clima23 horas agoLlegó el esperado alivio climático y continuará, sin lluvias, a lo largo de la semana










